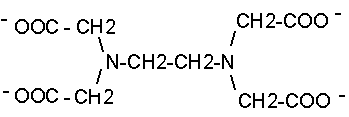
Aktualnych zadań etapu wstępnego L Olimpiady Chemicznej na rok szkolny
2003/2004 szukajcie na stronie
www.chem.uw.edu.pl/studia/olimp/
Podaję inne przykładowe zadania z etapu wstępnego
(XLVIII Olimpiada Chemiczna)
CZĘŚĆ A: Zadania obowiązkowe
Zadanie lA
Identyfikacja węglowodanów
Aldoheksoza szeregu D (związek A) w wyniku utleniania rozc. kwasem azotowym(V) tworzy kwas aldarowy (kwas 2,3,4,5-tetrahydroksyheksanodiowy, związek B) w formie mezo. W wyniku degradacji polegającej na skróceniu łańcucha węglowego aldozy A o jeden (o pierwszy) atom węgla (np. reakcja Ruffa) powstaje aldopentoza C, która z kolei podobnie utleniana za pomocą HN03 tworzy kwas 2,3,4trihydroksypentanodiowy (związek D) również o konfiguracji mezo.
Podaj:
a) wzory łańcuchowe Fischera aldoheksozy A, aldopentozy C, 2-ketoheksozy E - epimeru aldoheksozy A oraz obu kwasów aldarowych B i D;
b) wzór Hawortha disacharydu nieredukującego utworzonego z anomeru a piranozowej formy aldoheksozy A i anomeru (3 furanozowej formy 2-ketoheksozy E.
Zadanie 2A
Termodynamika reakcji chemicznych
a) Dla wyznaczenia standardowej entalpii tworzenia ciekłego 100 % kwasu siarkowego z substancji termodynamicznie prostych (pierwiastków w stanie podstawowym) można skorzystać ze znanych efektów energetycznych innych procesów. Oblicz zatem entalpię tworzenia 100% kwasu siarkowego na podstawie następujących danych termochemicznych:
standardowa entalpia utleniania siarki rombowej do gazowego SO2, ΔH1° =-297 kJ/mol
standardowa entalpia utleniania SO2 do S03, ΔH2°= -98 kJ/mol
standardowa entalpia tworzenia kwasu siarkowego w reakcji S03 z wodą, ΔH3°= -130 kJ/mol
standardowa entalpia spalania wodoru w tlenie do ciekłej wody, ΔH4° = -286 kJ/mol.
b) oblicz standardową entropię reakcji tworzenia 100 % kwasu siarkowego z substancji termodynamicznie prostych na podstawie następujących danych entropii molowych:
S°(H2) = 130,6 J/(molxK), S°(S) = 31,9 J/(molxK), S°(O2) = 205,0 J/(molxK), S°(H2S04) = 156,9 J/(molxK)
c) Zinterpretuj otrzymane wartości entalpii i entropii tej reakcji ze względu na ich wkład do jej spontanicznego przebiegu i oblicz wartość jej entalpii swobodnej w 298 K.
Zadanie 3A
Budowa związków kompleksowych
Przestrzenną symetrię ułożenia związków kompleksowych można przewidzieć na podstawie liczby wyodrębnionych wszystkich izomerów tych związków. Rozważ następujące przykłady.
1) Związek kompleksowy NiCI2X2 (gdzie X oznacza np. fosfinę PH3) występuje w postaci tylko jednego izomeru. Jakie jest przestrzenne ułożenie ligandów wokół jonu centralnego ?
2) Związek kompleksowy Pt(NH3)2Cl2 występuje w postaci dwóch izomerów. Jakie jest przestrzenne ułożenie ligandów wokół jonu centralnego ? Jaki to typ izomerii ?
3) Jakie przestrzenne ułożenia ligandów można teoretycznie przyjąć dla liczby koordynacyjnej 6 (zakładając, że jednakowe ligandy będą energetycznie równocenne) ?
4) kation kompleksowy [Co(NH3)4Cl2]+ występuje w postaci dwóch izomerów. Jakie jest przestrzenne ułożenie ligandów wokół jonu centralnego ? Jaki to typ izomerii ?
Zadanie 4A
Reakcja gazowych pierwiastków
Mieszanina chloru i wodoru ma w warunkach normalnych gęstość 1 g/dm3. Mieszaninę zapalono i - po oziębieniu - rozpuszczono otrzymany produkt reakcji w wodzie, otrzymując 1 dm3 roztworu. Po dodaniu 500 cm3 0,1 molowego roztworu wodorotlenku sodu wartość współczynnika pH otrzymanego roztworu była równa 2. Obliczyć objętość (w warunkach normalnych) mieszaniny chloru i wodoru użytej do reakcji.
Przyjąć masę molową wodoru = 1 g/mol, masę molową chloru = 35,5 g/mol i traktować obydwa pierwiastki jak gazy doskonałe.
Zadanie 5A
Rozpuszczalność związków żelaza
Wody naturalne zawierajq często rozpuszczone związki żelaza. W czasie gotowania wody jej pH może się podwyższać, osiągając po pewnym czasie wartość 7. Prowadzi to do wytrącenia trudno rozpuszczalnych uwodnionych tlenków lub wodorotlenku żelaza (III).
1. Dlaczego w czasie gotowania wody może nastąpić podwyższenie jej wartości pH ?
2. Jakie może być najwyższe możliwe stężenie wolnych jonów Fe3+ w wodzie naturalnej o pH = 6 ? Jaki procent tej zawartości żelaza pozostanie w formie rozpuszczalnej (w postaci jonów Fe3+), gdy w wyniku gotowania pH podwyższy się do 7 ? Iloczyn rozpuszczalności Fe(OH)3 wynosi Kso = 2,5 *10-39
3. Jak na rozpuszczalność Fe(OH)3 wpłynie dodanie do wody o odczynie obojętnym następujących substancji: a) CH3COOH, b) NH4Cl, c) NH3, d) KF ? Wybierz odpowiedź: wzrośnie, zmaleje, nie zmieni się i krótko uzasadnij.
Zadanie 6A
Kompleksy z EDTA
Anion kwasu etylenodiaminotetraoctowego (EDTA), oznaczany też symbolem Y4
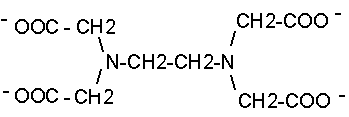
jest ważnym odczynnikiem kompleksującym, znajdującym przede wszystkim zastosowanie w analizie chemicznej. Tworzy kompleksy z wieloma jonami metali przejściowych, a także z jonami wapniowców. W kompleksach tych stosunek ilości metalu do ligandu wynosi 1:1.Przygotowano dwie próbki (A) i (B) zawierające po 5O cm3 roztworu soli wapnia w stężeniu 0,01 mol/dm3 . Do próbki (A) dodano 151 mg soli EDTA (Na2H2Y), a do próbki (B) 185 mg tej soli.
Oblicz stężenie wolnych jonów wapnia w obu próbkach. Jak zmieni się stężenie tych jonów, gdy oba roztwory zostaną dwukrotnie rozcieńczone ?
Stała trwałości kompleksu Ca2+ z EDTA wynosi β = 2· 109.
Zadanie 7A
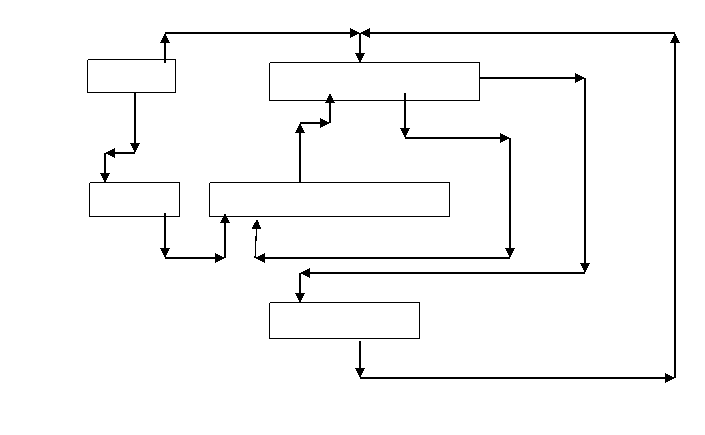
Pólspalanie metanu ( Zadanie sponsorowane przez PKN ORLEN SA w Płocku )
W procesie półspalania metanu w tlenie powstaje: acetylen, etylen, wodór, para wodna, tlenek i dwutlenek węgla oraz sadza. Gaz po procesie zawiera również nieprzereagowany metan. Całkowity stopień przemiany metanu wynosi 95%
( (WA[CH4]-WE[CH4])/WA[CH4]=O,95 ). Stężenie tlenu w mieszaninie z metanem (strumień WA) wynosi 38% objętościowych. Uproszczony schemat procesu przedstawiono na rysunku:

Stosunek molowy powstałego w reakcji tlenku węgla do nieprzereagowanego metanu wynosi 10 (WE[CO]/WE[CH4]=10). Stopień przemiany metanu w sadzę wynosi 2% (WD[C]/WA[CH4]=0.02). Stosunek molowy wytworzonej w reaktorze pary wodnej do tlenku węgla wynosi 1 (WD[H2O]/WE[CH4]=1 ).
Przyjmując za podstawę bilansu 100 kmo1/s strumienia WA wyznacz zależność ułamka molowego acetylenu (b) w strumieniu WE od n (n - stosunek molowy wytworzonego acetylenu do sadzy (WE[C2H2]/ WD[C]= n).
Uwaga: symbol WA[CH4] oznacza liczbę moli metanu w strumieniu A
Zadanie 8A
Wlasności tlenków niemetali
Chlor, siarka oraz fosfor tworzą tlenki na różnych stopniach utlenienia
a) Podaj wzory sumaryczne oraz nazwy tlenków wspomnianych pierwiastków występujących na:
maksymalnym stopniu utlenienia G
na stopniu utlenienia G - 2.
b) Napisz równania reakcji powyższych tlenków z wodą oraz ze stałym NaOH.
c) Które z uzyskanych w punkcie b) produktów będą ulegały hydrolizie. Zapisz cząsteczkowo oraz jonowo poszczególne etapy tych reakcji. Jakie będą odezyny środowiska po ich przebiegu?
d) Na jednym z przykładów wyjaśnij mechanizm przebiegu reakcji hydrolizy.
Poniżej przedstawiono wartości liczbowe pK dla wybranych kwasów t=20 °C.
H3PO4 - pK, =2,15 ; pK2=7,20 ; pK3=12,37
H2HP03 - pK, =1,3 ; pK2=6,7 H2SO4 – pK1 - mocny ; pK2= 1.9
HCIO4 - mocny H2S03 – pK1 =1,9 ; pK2= 7,2
HClO3 - mocny H20 - pKW=14
HClO2 - pK =1,94
CZĘŚĆ B: Zadania fakultatywne
Zadanie 1B
Analiza spektralna
Współczesna organiczna analiza jakościowa w coraz mniejszym stopniu korzysta z prób klasycznych (chemicznych). Do określania struktury związków stosuje się widma spektroskopowe takie jak: widma absorpcyjne w zakresie promieniowania widzialnego i nadfioletowego (w skrócie UV-Vis), widma absorpcyjne w zakresie promieniowania podczerwonego (IR), spektrometrię masową (MS) oraz widma magnetycznego rezonansu jądrowego (1H NMR, 13C NMR, 19F NMR i inne). Poniższe zadanie stanowi przykład wykorzystania niektórych danych spektroskopowych do jednoznacznego przypisania struktur związkom organicznym.
Podaj wzory strukturalne związków A - F, wiedząc że są one izomerami zawierającymi tylko węgiel, wodór i tlen, oraz mając do dyspozycji następujące dane spektroskopowe:
|
Związek |
Wybrane, charakterystyczne pasma IR (w cm-1) |
1H NMR: 8 w ppma (intensywność względna, multipletowość synału) |
Pasmo macierzyste w MS (odpowiadające masie czasteczkowej) |
|
|
A |
1715 |
1,05 (3, tryplet); 2,05 (3, singlet) 2,4 (2, kwartet) |
|
|
|
B |
1725; 2700 - 2900 |
1,0 (3, tryplet); 1,7 (2, mb); 2,4 (2, m); 9,75 (1, tryplet) |
|
|
|
C |
|
dwa sygnały o stosunku intensywności 1:1, δ = 1,9 i 3,6 |
72 |
|
|
D |
1640; |
1,3 (3, tryplet); 3,8 (2, kwartet); 4 - 4,2 (2, m); 6,5 (1, d-dc) |
|
|
|
E |
1725; 2700 - 2900 |
1,1 (6, dublet); 2,6 (1, m); 9,5 ( 1 , dublet) |
|
|
|
F |
1640 3330(szerokie) |
1,5 (3, dublet); 2,5d (1); 4,6 (1,m); 5,2 (2, m); 6,0 (1, m); |
|
|
a wobee wzorca wewnętrznego TMS (tetrametylosilan), dla którego δ = 0 ppm;
b m - sygnał złożony (multiplet);
c d-d - dublet dubletów (cztery składowe); .
d - podane przesunięcie chemiczne dotyczy widma wykonanego w CDCl3,
wartość ta zależy od użytego rozpuszczalnika, i co więcej, na widmie wykonanym w obecności D2O sygnał ten zanika.
Zadanie 2B
Kompleks oktaedryczny
Cząsteczka obojętnego elektrycznie kompleksu platyny(IV): PtCl2Br2(NH3)2, ma symetrię oktaedryczną, typową dla liczby koordynacyjnej 6. Związek ten występuje w różnych odmianach izomerycznych. Podaj, jakie typy izomerii są możliwe dla tego połączenia i wymień wszystkie możliwe izomery. W rozwiązaniu tego zadania, podobnie jak analogicznego zadania z części A, może pomóc zbudowanie prostych modeli przestrzennych PtCl2Br2(NH3)2.
Zadanie 3B
Kinetyka chemiczna - wyznaczanie stałych szybkości reakcji
Jednym z typowych eksperymentów z kinetyki chemicznej jest polarymetryczne badanie reakcji inwersji sacharozy w środowisku wodnym, z udziałem jonów H+ jako katalizatora. W trakcie tej reakcji obserwuje się stopniową zmianę kąta skręcenia płaszczyzny światła spolaryzowanego (α) od wartości dodatnich (odpowiadających czystej sacharozie) do ujemnych, odpowiadających powstającej równomolowej mieszaninie glukozy i fruktozy. Przykładowe dane, odpowiadające kinetyce inwersji sacharozy rozpuszczonej w dużym nadmiarze 0,5-molowego roztworu kwasu solnego, w temperaturze 298 K, zestawia poniższa tabela:
|
t [min] |
0 |
180 |
Niesk. |
|
α[deg] |
24,9 |
5,6 |
-8,2 |
1. Napisz równanie reakcji inwersji sacharozy
2. Na podstawie warunków prowadzenia procesu określ, kinetykę jakiego rzędu można najprawdopodobniej przypisać badanej reakcji
3. Oblicz stałą szybkości tej reakcji
4. Oblicz czas, dla którego płaszczyzna światła spolaryzowanego nie będzie skręcona o żaden kąt w stosunku do źródła tego światła.
Zadanie 4B
Konfiguracja absolutna
Oznacz konfigurację węgla chiralnego w następujących związkach:
1. linalolu - przyjemnie pachnącym olejku otrzymywanym z kwiatów drzewa pomarańczowego
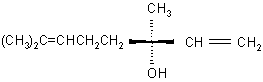
2. ibuprofenie - leku, którego tylko poniższy enancjomer posiada własności przeciwbólowe CH3
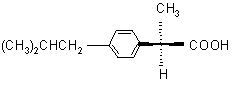
3. adrenalinie - hormonie, którego zapewne większe ilości krążą obecnie w twojej krwi (jest to
związek, który wydziela się , między innymi w stanie pogotowia do pracy

Zadanie 5B
Kinetyka chemiczna - zależność szybkości reakcji od temperatury
W początkach badań nad kinetyką reakcji chemicznych analizowano wpływ temperatury na otaczające nas procesy naturalne. Sformułowane wtedy empiryczne prawo van't Hoffa mówiło, że szybkość wielu takich reakcji ulega dwu-trzykrotnemu przyspieszeniu przy podwyższeniu temperatury o każde 10°C. Później zależności szybkości od temperatury uzyskały bardziej ogólną postać, dzięki pracom S. Arrheniusa.
1) O czym świadczy zależność stałej szybkości reakcji od temperatury ? A o czym świadczyłby brak takiej zależności ? Czy można oczekiwać, że szybkość reakcji będzie stale rosła z temperaturą ? Odpowiedź uzasadnij.
2) Oblicz energie aktywacji reakcji, jeśli 2,5-krotne zwiększenie jej stałej szybkości dotyczy zmiany temperatury: a) od 0 do 10°C, b) od 10°C do 20°C, c) od 20° do 30°C. Porównaj otrzymane wartości energii aktywacji.
Zadanie 6B
Reakcje cykloheksenu
Na cykloheksen podziałano podanymi niżej odczynnikami. Narysuj wzory przestrzenne produktów reakcji (uwzględnij, tam gdzie jest to możliwe, stereospecyfikę reakcji).
a) Br2 b) roztworem KMnO4 w temp. pokojowej
c) O3 a następnie Zn/H2O d) Cl2 / H2O
d) NBS
e) NBS a następnie KOH / EtOH
Zadanie 7B
Wpływ kwasowości na rozpuszczalność osadów i trwałość kompleksów
Podwyższenie kwasowości roztworu może spowodować rozpuszczenie trudno rozpuszczalnego osadu oraz rozpad kompleksu. Taki przypadek wystąpi, gdy anion trudno rozpuszczalnej soli oraz ligand wchodzący w skład kompleksu są zasadami Brönsteda.
Można to rozpatrzyć na przykładzie trudno rozpuszczalnego CaF2 i kompleksu AlF63-. Oblicz, (a) ile razy wzrośnie rozpuszczalność (stężenie wolnych jonów Ca2+) CaF2 oraz (b) ile razy wzrośnie stężenie wolnych jonów Al3+ w roztworze zawierającym AlF63- w stężeniu 0,01 mol/dm3 i jony fluorkowe w stężeniu 0, 1 mol/dm3, przy obniżeniu pH z 7 do 2.
Iloczyn rozpuszczalności CaF2, KSo = 3,2· 10-11,
stała trwałości kompleksu AlF63-, β6 = 5·1019,
stała dysocjacji kwasowej HF, Ka = 6,3· 10-4.
Zadanie 8B
Identyfikacja związku nieorganicznego
Związek X jest solą tworzącą się w wyniku reakcji wodorotlenku pierwiastka A oraz jednego z podstawowych kwasów.
- W wyniku dodawania do 0,1 M roztworu wodnego związku X zasady sodowej, wytrąca się szarozielonofioletowy osad Xl, który rozpuszcza się w nadmiarze NaOH z utworzeniem zielonego roztworu X1'.
- Związek X1 poddany prażeniu w temp. wyższych od 500 °C przechodzi w zielony proszek X2. Wspomniana reakcja jest jedną z wagowych metod oznaczania pierwiastka A.
- Związek X2 w podwyższonej temperaturze w reakcji w fazie stałej z azotanem(V) sodu oraz węglanem(IV) sodu tworzy produkt X3 w którym pierwiastek A znajduje się na +6 stopniu utlenienia. Produktami tej reakcji są dodatkowo azotan(III) sodu oraz tlenek węgla(IV). W wyniku rozpuszczenia związku X3 w wodzie uzyskuje się charakterystyczne żółte zabarwienie.
- W trakcie dodawania do 0,1M roztworu wodnego związku X azotanu(V) srebra nie przebiega jakakolwiek zauważalna reakcja.
a) Podaj wzór chemiczny związku X oraz jego nazwę.
b) Podaj wzory oraz nazwy związków X1, Xl', X2, X3. Napisz równania reakcji chemicznych zachodzących w trakcie ich tworzenia.
c) Napisz i zbilansuj równanie reakcji tworzenia związku X3. Napisz odpowiednie równania reakcji połówkowych przebiegających w tym układzie. Wskaż jaką rolę spełniają w niej poszczególne substraty.
Zadanie 9B
Proces technologiczny
Związek K jest używany w wielu dziedzinach przemysłu. Surowcami w technologicznym procesie otrzymywania tego związku są: solanka, wapień i woda amoniakalna. Poniżej przedstawiono reakcje zachodzące w procesie technologicznym:
Masy molowe występujących w procesie związków wynoszą odpowiednio [g/mol]:A = 100, B = 56, C = 44, D = 58,5, E = 17, F = 18, G = 53,5, H = 84, I = 74, J = 111, K = 106.
Masy molowe pierwiastków tworzących te związki wynoszą odpowiednio (g/mol): H = l, C = 12, N = 14, O = 16, Na = 23, Cl = 35,5, Ca = 40,
1. Podać wzory związków oznaczonych literami: A, B, C, D, E, F, G, H, I, J i K
2. Wyjaśnić jak i dlaczego przebiega proces D + E + F = G + H